هموکروماتوز برای اولین بار در سال 1889 به عنوان یک بیماری جداگانه توصیف شد. با این وجود می توان با پیشرفت ژنتیک پزشکی دلایل بیماری را دقیقاً مشخص کرد.
چنین طبقه بندی نسبتاً دیررس با ماهیت بیماری و توزیع نسبتاً محدود آن ترویج شد.
بنابراین ، براساس داده های مدرن ، 0.33 درصد از ساکنان جهان در معرض خطر ابتلا به هموکروماتوز هستند. چه عواملی باعث ایجاد بیماری شده و علائم آن چیست؟
هموکروماتوز - چیست؟
 این بیماری ارثی است و با کثرت علائم و خطر بالای عوارض جدی و آسیب شناسی همراه مشخص می شود.
این بیماری ارثی است و با کثرت علائم و خطر بالای عوارض جدی و آسیب شناسی همراه مشخص می شود.
مطالعات نشان داده اند که هموکروماتوز بیشتر در اثر جهش در ژن HFE ایجاد می شود.
در نتیجه خرابی ژن ، مکانیسم جذب آهن در اثنی عشر مختل می شود.. این امر به این واقعیت منجر می شود که بدن در مورد کمبود آهن در بدن یک پیام کاذب دریافت می کند و به طور فعال و در مقادیر اضافی پروتئین ویژه ای را می چسبد که به آهن متصل می شود.
این منجر به رسوب بیش از حد hemosiderin (رنگدانه غده) در اندام های داخلی می شود. در کنار افزایش سنتز پروتئین ، فعال شدن دستگاه گوارش اتفاق می افتد و منجر به جذب بیش از حد آهن از مواد غذایی در روده می شود.
بنابراین حتی با تغذیه طبیعی ، مقدار آهن موجود در بدن بسیار برابر بیشتر از حد طبیعی است. این منجر به از بین رفتن بافت های اندام های داخلی ، مشکلات سیستم غدد درون ریز و ایمنی بدن می شود.
طبقه بندی بر اساس انواع ، فرم ها و مراحل
در عمل پزشکی ، انواع اولیه و ثانویه بیماری تقسیم می شود. در این حالت ، اصلی ، که به آن ارثی نیز گفته می شود ، نتیجه یک تمایل ژنتیکی است. هموکروماتوز ثانویه نتیجه توسعه انحراف در کار سیستم های آنزیمی درگیر در متابولیسم غده است.
چهار نوع از بیماری ارثی (ژنتیکی) از بیماری شناخته شده است:
- کلاسیک
- نوجوان؛
- ارثی HFE گونه های جدا نشده.
- اتوزومال غالب.
نوع اول با جهش کلاسیک مغلوب ناحیه ششم کروموزوم همراه است. این نوع در اکثر موارد تشخیص داده می شود - بیش از 95 درصد بیماران از هموکروماتوز کلاسیک رنج می برند.
نوع بیماری نوجوانان در نتیجه جهش در ژن دیگری یعنی HAMP رخ می دهد. تحت تأثیر این تغییر ، سنتز هپسیدین ، آنزیمی که مسئول رسوب آهن در اندامها است ، به میزان قابل توجهی افزایش می یابد. معمولاً این بیماری در سنین ده تا سی سالگی بروز می یابد.
نوع جدا نشده HFE در صورت عدم موفقیت ژن HJV ایجاد می شود. این آسیب شناسی شامل مکانیسم بیش فعالی گیرنده های ترانسفرین-2 است. در نتیجه ، تولید هپسیدین شدت می یابد. تفاوت با نوع بیماری نوجوانان در این است که در حالت اول ، یک ژن از کار می افتد ، که مستقیماً مسئول تولید آنزیم اتصال دهنده آهن است.
 در حالی که در حالت دوم ، بدن یک ویژگی خاصیت اضافی آهن در مواد غذایی ایجاد می کند ، که منجر به تولید آنزیم می شود.
در حالی که در حالت دوم ، بدن یک ویژگی خاصیت اضافی آهن در مواد غذایی ایجاد می کند ، که منجر به تولید آنزیم می شود.
نوع چهارم هموکروماتوز ارثی با نقص ژن SLC40A1 همراه است.
این بیماری در پیری ظاهر می شود و با سنتز نادرست پروتئین فروپورتین ، که وظیفه انتقال ترکیبات آهن به سلول ها را دارد همراه است.
جهش Missense و عوامل خطر
 جهش ژنتیکی در نوع وراثتی بیماری نتیجه پیامدهای شخص است.
جهش ژنتیکی در نوع وراثتی بیماری نتیجه پیامدهای شخص است.
مطالعات نشان می دهد که اکثر بیماران ساکن سفیدی آمریکای شمالی و اروپا هستند و بیشترین تعداد افراد مبتلا به هموکروماتوز مبتلا به هموکروماتوز در بین مهاجران از ایرلند مشاهده می شوند.
علاوه بر این ، شیوع انواع مختلف جهش ها برای نقاط مختلف جهان مشخص است. مردان چندین برابر بیشتر از خانم ها مستعد ابتلا به این بیماری هستند. در حالت دوم ، علائم معمولاً پس از تغییرات هورمونی در بدن ناشی از یائسگی بروز می کند.
در بین بیماران ثبت شده ، زنان 7-10 برابر کمتر از مردان هستند. دلایل تغییر هنوز مشخص نیست. فقط ماهیت ارثی این بیماری غیرقابل انکار است و ارتباط بین وجود هموکروماتوز و فیبروز کبد نیز ردیابی می شود.
 در حالیکه رشد بافت همبند را نمی توان مستقیم با تجمع آهن در بدن توضیح داد ، تا 70٪ بیماران هموکروماتوز فیبروز کبدی داشتند.
در حالیکه رشد بافت همبند را نمی توان مستقیم با تجمع آهن در بدن توضیح داد ، تا 70٪ بیماران هموکروماتوز فیبروز کبدی داشتند.
علاوه بر این ، یک پیشگیری ژنتیکی لزوماً منجر به پیشرفت بیماری نمی شود.
علاوه بر این ، یک شکل ثانویه هموکروماتوز وجود دارد ، که در افرادی که ژنتیک در ابتدا طبیعی هستند مشاهده می شود. عوامل خطر همچنین برخی از آسیب شناسی ها را شامل می شود. بنابراین ، استئاته هپاتیت منتقل شده (رسوب غیر الکلی بافت چربی) ، ایجاد هپاتیت مزمن علل مختلف و همچنین انسداد لوزالمعده در بروز بیماری نقش دارد.
علائم هموکروماتوز در زنان و مردان
 در گذشته ، تنها ایجاد تعدادی از تظاهرات جدی علامتی باعث شده بود تا این بیماری تشخیص داده شود.
در گذشته ، تنها ایجاد تعدادی از تظاهرات جدی علامتی باعث شده بود تا این بیماری تشخیص داده شود.
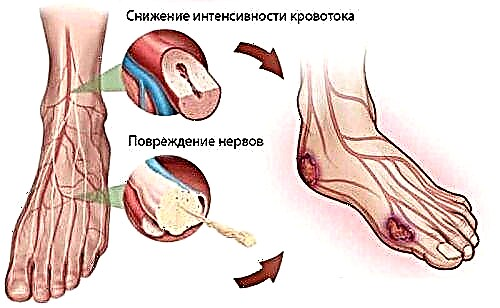
بیمار با تجمع بیش از حد آهن احساس خستگی مزمن ، ضعف می کند.
این علائم برای 75٪ بیماران هماتوکروماتوز مشخص است. رنگدانه های پوستی افزایش یافته و این روند با تولید ملانین همراه نیست. به دلیل تجمع ترکیبات آهن در آنجا ، پوست تیره تر می شود. تیرگی در بیش از 70٪ بیماران مشاهده شده است.
اثر منفی آهن تجمع یافته بر روی سلولهای ایمنی بدن باعث ضعف ایمنی می شود. بنابراین ، با روند بیماری ، استعداد بیمار در برابر عفونت ها افزایش می یابد - از شرایط کاملاً جدی تا پیش پا افتاده و بی ضرر در شرایط عادی.
 حدود نیمی از بیماران از آسیب شناسی های مفصلی رنج می برند که در بروز درد بیان می شود.
حدود نیمی از بیماران از آسیب شناسی های مفصلی رنج می برند که در بروز درد بیان می شود.
همچنین در تحرک آنها رو به وخامت گذاشته شده است. این علائم به وجود می آید زیرا مقدار زیادی از ترکیبات آهن باعث رسوب کلسیم موجود در مفاصل می شوند.
آریتمی و ایجاد نارسایی قلبی نیز ممکن است. تأثیر منفی بر لوزالمعده اغلب منجر به دیابت می شود. آهن بیش از حد باعث اختلال در عملکرد غدد عرق می شود. در موارد نسبتاً کمیاب ، سردرد مشاهده می شود.
بروز این بیماری منجر به ناتوانی جنسی در مردان می شود. کاهش عملکرد جنسی نشانگر علائم مسمومیت بدن با محصولات مرکب آهن است. در خانمها خونریزی شدید هنگام تنظیم ممکن است.
 یک علائم مهم افزایش کبد و همچنین دردهای شدید شکمی است که به نظر می رسد شناسایی سیستمیک ممکن نیست.
یک علائم مهم افزایش کبد و همچنین دردهای شدید شکمی است که به نظر می رسد شناسایی سیستمیک ممکن نیست.
وجود چندین علائم نشانگر لزوم تشخیص دقیق آزمایشگاهی بیماری است.
علامت بیماری وجود هموگلوبین زیاد در خون است که مقدار کم آن همزمان در گلبولهای قرمز وجود دارد. شاخصهای اشباع ترانسفرین با آهن زیر 50٪ نشانه آزمایشگاهی هموکروماتوز محسوب می شوند.
افزایش قابل توجه کبد با تراکم بالای بافت های آن نیز از علائم بیماری است. علاوه بر این ، با هموکروماتوز ، تغییر رنگ بافت کبد مشاهده می شود.
چگونه در کودک بروز می کند؟
 هموکروماتوز اولیه دارای چندین ویژگی است - از جهش هایی که باعث شده است تا مناطق کروموزوم مربوط به تصویر و تظاهرات بالینی مشخص شود.
هموکروماتوز اولیه دارای چندین ویژگی است - از جهش هایی که باعث شده است تا مناطق کروموزوم مربوط به تصویر و تظاهرات بالینی مشخص شود.
اول از همه ، علائم بیماری در سنین پایین چند شکل است.
کودکان با ایجاد علائم و نشانه های فشار خون بالا در پورتال مشخص می شوند. نقض جذب مواد غذایی ، افزایش همزمان طحال و کبد ایجاد می کند.
با توسعه پاتولوژی ، سنگین و مقاوم در برابر اثرات درمانی آسیت - قطره ای که در ناحیه شکم تشکیل می شود. رشد واریس مری مشخص است.
چه آزمایشات و روشهای تشخیصی به شناسایی آسیب شناسی کمک می کند؟
 برای شناسایی این بیماری از چندین روش مختلف تشخیصی آزمایشگاهی استفاده می شود.
برای شناسایی این بیماری از چندین روش مختلف تشخیصی آزمایشگاهی استفاده می شود.
در ابتدا نمونه گیری خون برای بررسی سطح هموگلوبین در گلبول های قرمز و پلاسما انجام می شود.
ارزیابی متابولیسم آهن نیز انجام می شود.
آزمایش desferal به تأیید تشخیص کمک می کند. برای انجام این کار ، تزریق داروی غده ای انجام می شود و پس از پنج ساعت نمونه ادرار گرفته می شود. علاوه بر این ، CT و MRI اندامهای داخلی برای تعیین تغییرات آسیب شناختی آنها انجام می شود - افزایش اندازه ، رنگدانه و تغییر در ساختار بافت.
اسکن ژنتیکی مولکولی به شما امکان می دهد وجود یک قسمت آسیب دیده از کروموزوم را مشخص کنید. این مطالعه که در بین اعضای خانواده بیمار انجام شده ، به ما امکان می دهد حتی قبل از شروع تظاهرات بالینی آن که بیمار را مختل می کند ، احتمال بروز این بیماری را نیز ارزیابی کنیم.
اصول درمانی
روش های اصلی درمان عادی سازی نشانه های میزان آهن در بدن و جلوگیری از آسیب رساندن به اندام ها و سیستم های داخلی است. متأسفانه ، طب مدرن نحوه عادی سازی دستگاه ژن را نمی داند.

خون ریزی
روش متداول درمان خون ریزی است. با درمان اولیه ، هفته ای 500 میلی گرم خون برداشته می شود. پس از نرمال شدن میزان آهن ، وقتی نمونه گیری خون هر سه ماه انجام می شود ، به درمان درمانی می روند.
تجویز داخل وریدی داروهای اتصال دهنده آهن نیز انجام می شود. بنابراین ، شلاتات اجازه می دهد تا مواد اضافی را با ادرار یا مدفوع از بین ببرید. با این وجود ، یک دوره کوتاه از عمل باعث می شود تزریق زیر جلدی داروها به کمک پمپ های ویژه ضروری باشد.
عوارض و پیش آگهی های احتمالی
با تشخیص زودرس ، بیماری به طور مؤثر قابل کنترل است.طول مدت و کیفیت زندگی بیمارانی که مراقبت منظم از آنها انجام می شود ، متفاوت از افراد سالم نیست.
علاوه بر این ، درمان به موقع منجر به عوارض جدی می شود. این موارد شامل ایجاد سیروز و نارسایی کبدی ، دیابت ، آسیب به رگها تا خونریزی است.
احتمال ابتلا به کاردیومیوپاتی و سرطان کبد خطر بالایی دارد ، همچنین عفونت های هم زمان مشاهده می شود.
فیلم های مرتبط
درباره آنچه هموکروماتوز است و چگونه آن را درمان می کنیم ، در مجموعه تلویزیونی "سالم زندگی کنید!" با النا ملیشوا: